
El carbono-14 (14C, masa atómica = 14,003241 uma) es un isótopo del carbono. En la naturaleza se suele hallar como carbono-12. Su núcleo contiene 6 protones y 8 neutrones. Debido a su presencia en todos los materiales orgánicos, el carbono-14 se emplea en la datación de especímenes orgánicos.
El método de datación por radiocarbono es la técnica más fiable para conocer la edad de muestras orgánicas de menos de 60.000 años. Para ello se utiliza la ley de decaimiento exponencial de los isótopos radiactivos.
Este isótopo carbono-14 (14C) es producido de forma continua en la atmósfera como consecuencia del bombardeo de átomos de nitrógeno por neutrones cósmicos. Es inestable, lo que puede da lugar a su trasmutación en nitrógeno-14 (14N). Estos procesos de generación-degradación de 14C se encuentran prácticamente equilibrados, de manera que el isótopo se encuentra homogéneamente mezclado con los átomos no radiactivos en el dióxido de carbono de la atmósfera.
Mediante el proceso de fotosíntesis, las plantas incorporan el átomo radiactivo, de manera que la proporción 14C/12C en éstas es similar a la atmosférica. Los animales incorporan, por ingestión, el carbono de las plantas. Ahora bien, tras la muerte de un organismo vivo no se incorporan nuevos átomos de 14C a los tejidos, y la concentración del isótopo va decreciendo conforme va transformándose en 14N por decaimiento radiactivo.
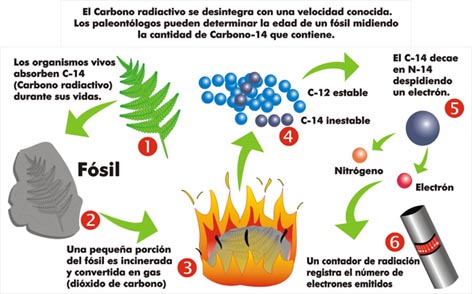
Aunque el carbono-14 es muy útil para mediciones de edad, tiene el inconveniente de que si la edad del material analizado supera los 60.000 años, no es demasiado exacto, por lo que se utiliza el radio-isótopo del potasio con el mismo procedimiento.